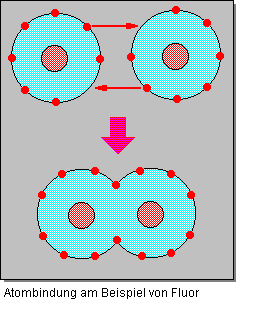
Bei diesem Bindungstyp teilen sich die beteiligten Atome gemeinsam Elektronenpaare, so daß nach außen hin Edelgaskonfiguration erreicht wird. Aus diesem Grund wird die Atombindung auch Elektronenpaarbindung genannt. Die Bindungselektronen werden also Teil der Elektronenhüllen beider Atome. Aus den beiden Atomorbitalen entsteht ein gemeinsames Molekülorbital, das die Atome gleichmäßig umgibt. Da es hierbei zu keiner Ladungsverschiebung wie bei der Ionenbindung kommt, wird dieser Typ auch als homöopolare bzw. unpolare Bindung bezeichnet. Desweiteren ist die Bezeichnung kovalente Bindung gebräuchlich.
Atombindungen treten nur zwischen Atomen mit mehr oder weniger elektronegativen Charakter auf. Diese Bindungsart ist also typisch für Nichtmetallatome und somit besonders bedeutsam für die organischen Verbindungen.
Kovalente Bindungen werden bevorzugt zwischen den Atomen des gleichen Elements ausgebildet. Hierunter fallen die elementaren, zweiatomigen Gase wie zum Beispiel H2, O2 oder Cl2. Auch zwischen Elementen mit ähnlichem chemischen Charakter entstehen kovalente Bindungen: z.B. Kohlendioxid oder Kohlenstoffdisulfid. Typische Verbindungen mit kovalenter Bindung sind Wasser (H2O) oder die Alkane (CnH2n+2).
Entsprechend der Oktettregel bestimmt die Anzahl der Außenelektronen die Anzahl der möglichen Bindungen. So kann Kohlenstoff mit vier Außenelektronen vier Bindungen eingehen, zum Beispiel:
- Methan CH4 – vier Einfachbindungen;
- Kohlendioxid CO2 – zwei Doppelbindungen;
- ausäure HCN – eine Einfach- und eine Dreifachbindung.
Strenggenommen gilt die Oktettregel aber nur für die ersten beiden Perioden, da ab der dritten Periode auch die d-Oritale Valenzelektronen enthalten können.
Zu polarisierten Atombindungen kommt es, wenn zwei stark elektronegative Elemente ein gemeinsames Elektronenpaar bilden. In diesem Falle zieht das elektronegativere Element das Elektron des Bindungspartners stärker zu sich heran. Dadurch entsteht eine leichte Asymmetrie der Ladungsverteilung und das Atom des stärker elektronegativen Elements erhält eine negative Partialladung. Solche Partialladungen sind aber stets kleiner als die Ladungen von Ionen. Ein gutes Beispiel für die polarisierte Atombindung ist Fluorwasserstoff, wo das Valenzelektron von Wasserstoff stärker von Fluor angezogen wird, so daß Wasserstoff eine positive Partialladung in dieser Verbindung hat. Das Molekül verhält sich wie ein Dipol, das sich einem homogenen elektrischen Feld entsprechend der Feldlinie ausrichtet.
Auch Wasser ist ein Dipol-Molekül, wobei der Schwerpunkt der negativen Ladung beim Sauerstoff liegt. Die besonderen Eigenschaften des Wassers erklären sich aus dem Dipol-Charakter des Wassers.
