- Symbol: C
- szahl: 6
IV. Hauptgruppe (Kohlenstoffgruppe)
Namensbedeutung
Das Elementsymbol für Kohlenstoff (C) bedeutet carboneum und leitet sich von carbo, dem lateinischen Wort für Kohle, ab. Im englischen wird es carbon genannt.
Entdeckung und historische Bedeutung
Kohlenstoff war bereits den prähistorischen Menschen bekannt. Schon in der Altsteinzeit wurde er in Form von Holzkohle verwendet und im Altertum erkannte man, dass sich Holzkohle durch Steinkohle ersetzen ließ. Die Römer nannten sie carbo fossiles und setzten sie zur Metallgewinnung ein. Auch die Chinesen verwendeten sie schon frühzeitig beispielsweise für die Porzellanherstellung.
Jedoch erkannte erst A.L. Lavoisier 1775, dass es sich um ein eigenständiges Element handelt und gab ihm den Namen Carboneum. So wusste man im ausgehenden 18. Jahrhundert, dass Graphit und Diamant verschiedene Formen des Elementes waren. Um 1830 setzte schließlich eine sprunghafte Entwicklung der synthetischen organischen Chemie ein, die nach der Einführung des Valenzbegriffes zwanzig Jahre später noch beflügelt wurde. Heute ist die organische Chemie ein eigenständiger Zweig der chemischen Wissenschaften.
* A.L. Lavoisier (Biographische Daten)
Bedeutung und Vorkommen
| Häufigkeiten | in % | in ppm |
|---|---|---|
| Weltall | 0,460 | 4600 |
| Sonne | 0,390 | 3900 |
| Erdkruste | 0,020 | 200 |
| Meer | 0,0028 | 28 |
| Mensch | 22,9 | 230000 |
Das uns bekannte Weltall weist einen Kohlenstoffanteil von 0,008% Kohlenstoff auf. Im interstellaren Raum findet man reinen Kohlenstoff unter anderem auch im Form seiner bis 1985 unbekannten Modifikation, den Fulleren. Kometen enthalten im Mittel 0,035% Kohlenstoff.
Auf der Erde liegt sein Anteil bei ca. 0,99%. Am Aufbau der Erdkruste ist Kohlenstoff mit 480 ppm beteiligt. Die Angaben schwanken allerdings beträchtlich, andere Quellen sprechen lediglich von 180 ppm. Kohlenstoff kommt in elementarer Form als Diamant und Graphit vor. Graphit findet man praktisch überall auf der Erde. Die meisten Vorkommen sind allerdings technisch nicht nutzbar. Graphit hoher Reinheit ist dementsprechend knapp, so dass er in großem Umfang künstlich hergestellt wird. Sämtliche Diamanten findet man in alten Vulkanschloten in sogenannten Kimberlit-Gestein. Noch während der 50er Jahre stammten 99% der Diamantenproduktion aus Afrika, doch das änderte sich, als die Sowjetunion als Großförderer auf den Weltmarkt trat. Die größten Anbieter lupenreiner Diamanten sind Zaire, die GUS und Südafrika.
Der weitaus größere Teil des weltweiten Kohlenstoffs liegt allerdings in gebundener Form vor: Calciumcarbonat, Magnesiumcarbonat, Eisencarbonant und andere Carbonate bilden gewaltige Gebirgszüge. Kohle, Erdöl und Erdgas sind die wichtigsten Kohlenwasserstoffe, die als abgestorbenes pflanzliches und tierisches Material riesige Lagerstätten bilden.
Kohlendioxid ist das ökologisch wichtigste Spurengas der Atmosphäre. Sein Anteil an der Atmosphäre wird mit 0,035% angegeben. Durch die anhaltende Verbrennung fossiler Energieträger steigt der Anteil von Kohlendioxid in der Atmosphäre seit den vergangenen 250 Jahren meßbar an. Die Menge des im CO2 der Luft gebundenen Kohlenstoffs liegt heute bei schätzungsweise 600 Milliarden Tonnen.
Ökologische Bedeutung
Kohlenstoff ist an allen dynamischen Prozessen der Ökosphäre beteiligt. Der globale Kohlenstoffkreislauf stellt die Grundbedingung für die Entstehung und Entwicklung des Lebens auf der Erde dar. Ohne Kohlenstoff gäbe es auf der Erde weder pflanzliches noch tierisches Leben! Der Kohlenstoffgehalt der gesamten Biomasse wird auf 300 Milliarden Tonnen geschätzt. Im menschlichen Körper ist es mit 10,7% nach Wasserstoff und Sauerstoff das wichtigste Element.
* Kohlenstoffkreislauf
Eigenschaften
Kohlenstoff ist ein typisches Nichtmetall, von dem heute drei verschiedene Modifikationen bekannt sind: Diamant, Graphit und Fullerne. In ihren Eigenschaften unterscheiden sich die beiden wichtigen Modifikationen grundsätzlich voneinander.
- Diamant bildet eine dreidimensionale Raumnetzstruktur; Diamantkristalle sind äußerst hart, sehr stabil und klar wie Glas. Entsprechend der Mohs’schen Härteskala nimmt Diamant die höchste Stufe 10 ein. Diese Kohlenstoffmodifikation hat mit 3823 K den höchsten Schmelzpunkt aller Elemente. Diamant leitet elektrischen Strom nicht. Innerhalb des Diamantkristalls sind die Kohlenstoffatome über kovalente Bindungen miteinander verbunden, sie sind dabei sp³-hybridisiert.
- Graphite ist die häufigste Form reinen Kohlenstoffs. Im Gegensatz zu Diamant ist Graphit sehr weich. Es handelt sich um mattschwarze, schuppige Kristalle. Graphit fühlt sich leicht fettig an. Alle Kohlenstoffatome sind sp²-hybridisiert. Dies hat ebene Sechsringgitter zur Folge, die in vielen Schichten übereinandergelagert sind. Parallel zu den Schichten leitet Graphik sehr gut Wärme und elektrischen Strom. Senkrecht zu den hexagonalen Kohlenstoffschicht wirkt es als Isolator. − Die früher als amorpher Kohlenstoff bezeichneten Formen Ruß und Aktivkohle sind keine Modifikation, sondern lediglich mikrokristalline Formen von Graphit.
- Bei den Fullerenen handelt es sich um ein seltene Kohlenstoffmoleküle mit meist 60 C-Atomen. Fullerene haben die Form eines Fußballs. Die Existenz wurde schon einige Jahre vor ihrer Entdeckung diskutiert. Sie konnten aber 1985 nachgewiesen werden. Inszwischen sind auch Fullerene bekannt, die aus 28, 32, 50 und 70 Kohlenstoffatomen zusammengesetzt sind.
Kohlenstoffverbindungen
Die Fähigkeit des Kohlenstoff, lange Ketten oder Ringe zu bilden, bedingt die große Vielzahl an chemischen Verbindungen. Diese Fähigkeit prädestiniert das Element geradezu zur Gerüstsubstanz biologischer Organismen.
Insgesamt gibt es gegenwärtig ungefähr 5 Millionen Kohlenstoffverbindungen, womit die Zahl der Kohlenstoff-freien Verbindungen deutlich übertroffen wird (etwa 300.000). Die jährliche Zuwachsrate von Kohlenstoffverbindungen, die gefunden oder erzeugt werden, beträgt etwa eine viertel Million. Die meisten Kohlenstoffverbindungen werden von der organischen Chemie behandelt. Nur elementarer Kohlenstoff und einige seiner einfachsten Verbindungen, wie z.B. Oxide, Sulfide, Kohlensäure, Carbonate, Carbide und einfache Cyanverbindungen, werden zur anorganischen Chemie gerechnet.
- Carbide
- Carbonmonooxid
- Carbondioxid
- Cyanverbindungen
- Kohlenwasserstoffe
Isotope
Die wichtigsten Isotope sind zwei stabile, natürliche Isotope mit den Massenzahlen 12 und 13. Das erste hat einen Anteil von 98,9% und das zweite 1,1%. Von den instabilen Isotopen ist Kohlenstoff 14 mit einer Halbwertszeit von 5730 Jahren wohl am bekanntesten, da es zur Altersbestimmung fossiler Überreste verwendet wird.
- C-14-Methode
Verwendung
Die Anwendungen und Einsatzbereiche von Kohlenstoff-Verbindungen ist so vielfältig, dass darüber ganze Bücher geschrieben wurden: Kohle, Erdöl und Erdgas sind als fossile Energieträger die wichtigste Grundlage der Energiewirtschaft und damit Grundstütze der Industriegesellschaft mit all ihren ökologischen Konsequenzen. Die Kohlenwasserstoffe sind die Basis der Kunststoffindustrie und der Pharmabranche.
Selbst wenn man sich nur auf die Anwendungen von elementarem Kohlenstoff in Form von Naturgraphit konzentriert, erhält man bereits eine recht ansehnliche Liste wichtiger Anwendungen: Wegen seiner Hitzeresistenz wird es als Tiegelmaterial und Auskleidung für Öfen bzw. Gußformen verwendet. Es wird im Apperatebau und in Elektromotoren eingesetzt. Außerdem dient es als Schmier- und Gleitmittel. Und die alltäglichste Anwendung von Graphit sind wohl immer noch Bleistiftminen. Wegen dieser Anwendungsbreite wird das meiste genutzte Graphit inzwischen industriell hergestellt.
In einigen Reaktorlinien wird es als Moderatorsubstanz eingesetzt, was im Falle einer Havarie katastrophale Auswirkungen haben kann. So ist die russische RBMK-Baureihe − zu der auch der Tschernobyl-Reaktor gehört − von der Konstruktion ein Graphitreaktor. Die weltweite Produktion industriell erzeugten Graphits kann mit mehr als einer Million Tonnen pro Jahr veranschlagt werden.
Diamanten dienen nicht nur als Schmuck. Sie werden in Spezialgeräten unter anderem zum Bohren oder Schneiden eingesetzt. Auch hier wird ein Großteil heute industriell erzeugt.
Elementdaten
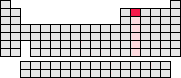
- Kohlenstoff (OZ: 6)
- IV. Hauptgruppe
- Kohlenstoffgruppe
Normalzustand
- Feststoff – Nichtmetall, drei Modifikationen: Graphit, Diamant und Fullere
- CAS-Nummer: 7440-44-0
- Kernladungszahl: 6
- rel. Atommasse: 12,011
- Kernladung: 3,25
Radien
- Atomradius: 77,2 pm
- Ionenradius: 16 (+4) pm
- Kovalenzradius: 77 pm
- Konfiguration: [He] 2s² 2p²
- Oxidationszahlen: 4, 2, -4
- Ionisierungseng.: 11,260
- Dichte: 3,51 D g/cm³
Elektronegativität
- Pauling: 2,55
- Allred & Rochow: 2,5
- Pearson: 6,27 eV
Temperatur
- Schmelzpunkt: 3823.0 K (3550 °C)
- Siedepunkt: 5100.0 K (4827 °C)
Natürliche Isotope
- C-12: 98,90%
- C-13: 1,10%
Entdeckung
- seit ca. 7000 Jahren bekannt, Lavoisier, 1775 (Erstbeschreibung), Frankreich
